Teilchen IV
Atomare Wertigkeit und Bindungen
Response and
Copyright © by Haertel Martin, All Rights Reserved, 12045
mailto mhaertel@naturgesetze.de
Inhaltsverzeichnis
Teilchen IV -
- Wertigkeit und Bindungen
1. Wertigkeit - Wärmekapazität - Edelgas
1a) H-Atom ohne E-Laufbahnrichtungswechsel
1b) Laufbahnänderungen ermöglichen
Edelgascharakter
1c) He-Elektronen rasen über kreuz
1e) Äussere Elektronen rasen bei Edelgasen kreuz
und quer
1f) Wertigkeiten - Wärmekapazitäten
1g) Wärmekapazität - Schmelzpunkte
1h) Engster E-Bahnradius bei Edelgasen
1i) Edelgase haben langwelligere weniger dichte
Minos-Schalen
2. Strahlenabgabe - Rand der Edelgase
2b) Gezielte Strahlenfreisetzung
2d) Edelgase sind am Rand langwelliger
2e) Bildung von weniger und grösseren
Umkehrschalen
3c) Minoszugabe ab 0 K - Atombindung
3d) Bindekurve der Atome von 0K bis zur Vollkugel
3e) Grundlage für den Aggregatszustand
3f) Warum sind Gase gasförmig ?
3g) Schmelzpunkt und Längenausdehnung
3i) Allgemeines zu ‘Nur 1 Elektron in
Endschale’
3j) Effekte bei nur 1 Elektron in Endschale
3k) Ergebnis bei nur 1 Elektron in Endschale
4. Kräfte und innere letzte Elektronenschale der Nukleonen
4a) Nukleon bzw. Atom nach aussen positiv und negativ
zugleich
4b) Kraftumkehrungen von Nukleonen
4d) Abstand von Protonen und Neutronen
4e) Elektronenrotation innerhalb Nukleonen
4f) Letzte Schale innerhalb eines Nukleons
4g) Vergleich letzte E-Schale Atom - Nukleon
4h) Proton mit 1 Elektron aussen
4j) Allgemeines zu Neutron und Proton
5a) Umkehrschalen am Neutronenrand
5b) Umkehrschalen am Protonenrand
5c) Bindeschalen a / b der Nukleonen
5d) Umgebungsunterschied Atom- und Nukleonenbindung
5e) Überschuss an Kernminos in Muttersternen
5f) Bindungskurve der Nukleonen
5g) Neutronen sind keine Gase - bei genug Entfernung
stossen sich alle Grossen ab
5h) Negative Suppe des Nukleonenkerns
6. Massenfluktuation + Aggregatszustand von Nukleonen
6a) Massenverhältnisse an Kern- und Atomrand
schwer eingrenzbar
6c) Massendifferenz von Proton/Neutron
unproblematisch
6d) Kraftdifferenz-Entwicklung bei Proton und Neutron
weiter weg
6e) Alle Ränder sind negativ und voll
6f) Aggregatszustand der Nukleonen
6g) Letztes Nukleonen-Elektron: Allgemeines zur
Schale
6h) Zerstrahlung und Neubildung von Starken
7a) Positiver Neutronenkern zieht fremde Elektronen
an
7c) Positiver Elektronenrand gefährdet
Stabilität
7d) Trägheit der Minosschalen wichtig
7e) Elektronenausklinken durch Kurzwellenzufuhr
7f) Elektronenausklinken mit mittleren Wellen
8a) Energie und Kraft oft proportional
8b) Durchschlüpfen durch Sperrschalen
8d) Nur eine Urladung Überschuss pro Teilchen
Teilchen IV
1. Wertigkeit - Wärmekapazität - Edelgas
. . zu 2. . . zu 3. . . zu 4. . . zum Inhaltsverzeichnis1a) H-Atom ohne E-Laufbahnrichtungswechsel
Bei einem alleinstehenden H-Atom (H1) kreist das Elektron ohne Richtungsänderung immer auf der gleichen Linie um das Proton (vgl. Impuls-Erhaltungssatz, der eine Richtungsänderung ohne Gegenimpuls verhindert). In der E-Laufrichtung wirkt das gesamte H-Atom weniger positiv, an den beiden 'leeren' Seiten dagegen viel positiver. In dieser E-Laufrichtung wirkt das H-Atom am Rand sogar zuerst negativ und hat erst ab einer Linie bei 110 bis 125% des Bahnradius des äussersten Elektrons eine Kraftumkehrung auf positiv. An beiden 'leeren' Seiten (den Achsen der Elektronenbahn) wirkt obiges H1-Atom von Anfang an positiv und weiter weg viel positiver als in der Richtung der Elektronenbahn. An einer dieser sehr positiven Seiten kann ein 2. Atom mit seiner weniger positiven Seite bzw. seinem negativen Rand andocken.1b) Laufbahnänderungen ermöglichen Edelgascharakter
Um so höher obige Plus-Minus-Differenz am Atomrand ist, um so besser und schneller funktioniert die Anbindung eines Nachbarn. Das erklärt die extrem hohe Bindungsfreudigkeit der rein 1-wertigen Elemente (H1, Li1, Na1, usw.). Beim Andocken eines Atoms an ein 1-Wertiges, kommen sich deren äusserstes Elektron relativ nahe. Sie zwingen sich gegenseitig zu einer Laufbahnänderung. Haben wir bei den Elektronen permanente ausreichende Laufbahnänderungen, so wirkt das Atom nach aussen ausgeglichen positiv und keine anderen Atome können mehr andocken (Edelgascharakter).1c) He-Elektronen rasen über kreuz
Haben bei He beide Elektronen denselben Bahnradius, so würden sie auf eine Gegenposition zueinander gehen und beide danach keinen Laufbahnrichtungswechsel mehr machen. He wäre dann noch viel bindungsfreudiger als H. Es ist aber genau das Gegenteil der Fall. Bei He kreist das 2. Elektron über Kreuz zum ersten, wenn sie unterschiedliche Bahnradien haben. Dabei verändern sie laufend gegenseitig ihre Bahnrichtung. Sie erreichen in planmässigen Abständen jeden Bereich ihrer Bahnoberfläche. 'Leere' oder nicht volle Seiten sind so ausgeschlossen. Beide Elektronen haben bei He einen kleinen Bahnradius. Damit hat He nach aussen eine sehr kleine Differenzenergie, wirkt wenig positiv und füllt sich am Rand nur mit wenig aber sehr langwelligen Minos auf.1d) Mehrwertige
Bei 2-Wertigen kreisen 2 Elektronen am Rand ohne Laufbahnänderungen. Man braucht entsprechend 2 'Gegenelektronen' um sie für den Edelgascharakter zu genügend Laufbahnänderungen zu zwingen. Es können 2 Einwertige oder ein Zweiwertiges oder noch Mehrwertiges andocken Bei Mehrwertigen wie B, C und N kreisen mehr als 2 Elektronen ohne Laufbahnänderung um den Atomkern, weshalb dieser H-Seiteneffekt nur entsprechend deren Wertigkeit mit noch mehr Gegenelektronen auszugleichen ist.1e) Äussere Elektronen rasen bei Edelgasen kreuz und quer
Edelgase haben eine volle letzte Elektronenschale (p-Schale mit 6 Elektronen) die aus 3 Unterschalen mit je 2 Elektronen besteht. Der Bahnradius dieser 2 Elektronen ist sehr nah beieinander, die Radien der Unterschalen 1, 2 und 3 ist etwas weiter auseinander. Der Abstand der p-Schale zu ihren Nachbarschalen (zB 2s, 3s) ist im Verhältnis nochmals weiter. Die beiden Elektronen jeder 2er-Schale (zB 2s, p-Unterschale 1,2,3) zwingen sich gegenseitig zu laufenden Bahnrichtungsänderungen. Deshalb hat ein Edelgas aussen an jeder Stelle seiner Kugeloberfläche (bei gleichem Abstand vom Kern) diesselbe Krafthöhe.1f) Wertigkeiten - Wärmekapazitäten
H, F, Cl, Na, Br und Cs haben extrem hohe Wärmekapazitäten pro Atom (höher als die der Edelgase; Li niedriger). Fast alle 2-wertigen wie Be, O, Ca, Fe, usw. liegen hier unterhalb der Wärmekapazitäten der Edelgase (Be und S liegen sehr hoch). 3- und bis 6-wertige verhalten sich hier änlich der 2-wertigen. Wertigkeiten wirken sehr nach weit aussen, Wärmekapazitäten dagegen oft mehr im Randbereich.1g) Wärmekapazität - Schmelzpunkte
Die Messung der Wärmekapazität bei H bezieht sich normal auf H2-Moleküle und nicht auf einzelne H1. Diese wirken beinahe wie He, nur dass sie wieder trennbar und dann 1-wertig sind. Bei 1-wertern ist die Wärmekapaziät pro Atom (ausser Li) hoch (grosser Durchmesser), ihre Wärmekapazität pro Raumeinheit aber sehr niedrig (wenig Atome). Sie können aussen nur etwas Langwelligere halten. Um so mehrwertiger, um so höher ist normalerweise ihr Schmelzpunkt. Einwertige können nur etwas langwelligere Minos (sind kräftiger) am Atomrand (ist schwächer) halten als wie Mehrwertige. Vergleichen Sie Li, F, Na und ihre niedrigen Schmelzpunkte.1h) Engster E-Bahnradius bei Edelgasen
Bei Edelgasen sind die Elektronen-Bahnradien durchschnittlich am engsten. Daher entsteht nach aussen die geringste positive Differenzenergie (Plus-Minus-Kraftdifferenz des Atoms). Somit baut sich am Atomrand gegenüber den Nachbarelementen das kleinste Schalensystem auf. Dieses liefert auch die kleinste Wärmekapazität pro Atom. Die grössere Kernnähe spielt nur eine geringe kraftfördernde Rolle, da nach aussen eine Differenzenergie entsteht, die fast nur radiusabhängig ist. Bei jedem Elektronen-Ausklinken (grösseres Element) wird der Atomkern immer stärker. Er zieht die E-bahnen immer näher heran. In gewissen Abständen entsteht aussen immer wieder eine neue Elektronenschale.1i) Edelgase haben langwelligere weniger dichte Minos-Schalen
Wegen der kleinen Bahnradien haben Edelgase gegenüber ihren Elementnachbarn nach aussen eine kleinere Differenzenergie. Diese Energie ist auf der gesamten Kugeloberfläche relativ gleichmässig verteilt (bei H anders). Da keine Energiespitzen bzw. -löcher vorhanden sind, können andere Atome an Edelgasen nicht so leicht andocken (keine tiefe Wertigkeitsbindung, nur flache Schmelzbindungen). Wegen der geringen Differenzenergie sind die Minos, welche von den Edelgasen festgehalten werden, um so kräftiger (grosswelliger). Das Verdrängen dieser Grossweller durch Kurzweller dauert entsprechend länger. Kräftigere Minos haben voneinander ausserdem höhere Abstände. Durch geringe Zufuhr (Überschuss) Kleinwelligerer lassen sich diese Atombindungen schon aufbrechen. Daher haben Edelgase niedrige Schmelzpunkte (langwellige Schalen). Diese Kurzwelligere brauchen auch nicht lange in diesen Schalen bleiben. Wenn die Atom-/Molekülbindung aufgebrochen ist, bleiben sie erstmal auseinander (vgl. kleine Fe-Kugeln, die sich nicht binden, ohne dass man sie vorher verflüssigt). Wegen der Dünne der Schalen (v.a. der äussersten) bzw. ihres grossen Minosabstandes kommt man an Schalen, welche Licht-Minos führen sehr leicht heran.2. Strahlenabgabe - Rand der Edelgase
. . zu 1. . . zu 3. . . zu 4. . . zu 5. . . zum Inhaltsverzeichnis. . Zurück zum Anfang
2a) Lichtabgabe bei Edelgasen
Sie sind bei 20°C Gase. Nun führt man Elektros (Minos des elektrischen Stroms) von allen Seiten heran. Sie dringen in das Schalensystem. Um so kurzwelliger, um so tiefer können sie zwischen den Langwelligeren nach innen 'wackeln'. Innen erhöhen sie den Raumbedarf dieser Schale, bzw. drängen Langwelligere etwas nach aussen. Diese an den Rand verdrängten Langwelligeren werden in die Umkehrschale gedrückt und von dort auf c nach aussen beschleunigt. Gerade bei den Edelgasen werden durch die Zufuhr von verhältnismässig wenig normalen Stromleitungs-Elektros extrem viele Licht-Minos herausgeschlagen.2b) Gezielte Strahlenfreisetzung
Je nach zugeführter Wellenlänge der Minos lassen sich entsprechend Minos mit genau definiertem Wellenlängenspektrum herausschlagen. Aus allen Elementen lassen sich somit über Elektros massenweise gezielt Gamma-, Licht-, Wärme-, Funk- und Schallteilchen herausbeschleunigen.2c) Bindungstiefe
Problem: Differenz von Schmelz- und Siedepunkten2d) Edelgase sind am Rand langwelliger
Die kleine Differenzenergie von Edelgasen (E-Bahnradien) verursacht eine kleinere positive Kraftspitze hinter der äussersten E-Schale. Damit fehlt dort die Möglichkeit viele sehr kurzwelligere Minos aufzunehmen. Die Schmelzpunkte sind tief. Grosswelligere haben eine grössere Kraftreichweite nach weit aussen. Damit wird die negative Kraft dieser Minos vom Atomkern viel später überflügelt.2e) Bildung von weniger und grösseren Umkehrschalen
Hinter den Minos- Schalen bildet sich bei Edelgasen je eine leere Umkehrschale mit negativer Kraft, welche viel weiter reicht. Vor dieser Umkehrschale stauen sich wieder langwellige Minos, welche eine nächste Umkehrschale erzeugen. Diese wird vom Atomkern schliesslich wieder überflügelt, usw.3. Bindung der Atome
. . zu 1. . . zu 2. . . zu 4. . . zu 5. . . zum Inhaltsverzeichnis. . Zum Anfang
3a) Gravitation aus Radien
Elektronen und Protonen (beide stark) wirken kräftemässig stark nach weit aussen (Schwache nur nah am Rand). Ihre positive Differenzenergie (wegen E-Bahnradien) stellt die Basis für ihre positive Gravitationskraft. Die Differenzenergie aus der Summe der quadrierten E-Bahnradien liefert die Basis ihrer Gravitation nach weit aussen. Mehr Elektronen/Protonen ziehen gemäss ihrer zusätzlichen Bahnradien stärker nach unten.3b) 0K
Die negative Energie der Minos in den Schalen am Atomrand hat nur eine kurze Kraftreichweite. Am Rand sind die Atome immer negative (Minosschalen) und weit aussen immer positiv. Damit haben sie aussen eine Kraftumkehrung auf positiv (vgl. Spulenkerne: Fe ist früher positiv wie Cu)3c) Minoszugabe ab 0 K - Atombindung
Bei 0 K stossen sich freie Atome (nicht gebunden) gegenseitig beträchtlich ab. Führt man Minos hinzu, so wird der Rand negativer und die Abstossung sinkt. Ab einer bestimmten Minosenergie, wirkt die positive Anziehung eines 2. Atomkerns auf den negativen Atomrand des 1. höher als die positive Abstossung zwischen beiden Kernen. Beide Atome ziehen sich an und binden sich dann aneinander. Bei zusätzlichem Einfluss wie Kollision oder Gravitation wird die Abstossung noch früher überwunden und die Atombindung erfolgt früher.3d) Bindekurve der Atome von 0K bis zur Vollkugel
Jedes Atom hat eine Bindekurve. Fügt man mehr Minos hinzu, so erhält man ab einer bestimmten Minosenergie die höchste Bindungskraft (Festzustand). Es sind möglichst viele weitere Atome an einem angedockt. Fügt man noch mehr Minos hinzu, so sinkt die Bindungskraft wieder, bis sie flüssig, gasförmig (nur 2-3 Bindungen pro Atom) und schliesslich alleine sind (alle stossen sich ab). Ein Atom nach dem anderen driftet weg, bis das Atom alleine ist. Von 0 K bis über den Gaszustand hinaus erhalten wir eine von der Minosenergie abhängige Bindekurve (vgl. auch: H2 ist gasförmig gebunden, H1 braucht noch mehr Minoszufuhr).3e) Grundlage für den Aggregatszustand
Der Aggregatszustand hängt einmal davon ab, um welches Element es sich handelt. Dabei ist entscheidend wieviel Elektronen ein Element hat und welche Radien diese Elektronen haben. Entsprechend verhalten sich die Wellenlängen der Schalen am Atomrand und ihr äusserster Rand. Bei 0 K bleiben die inneren Schalen alle unberührt. Gebundene Atome, Moleküle, usw. verlieren bei 0 K nur den alleräussersten Rand.3f) Warum sind Gase gasförmig ?
Speziell mit Gasen hat dieses wenig zu tun. Alle Elemente sind bei unterschiedlichen Temperaturen gasförmig. Warum sind sie bei mehr oder weniger Temperatur fest/flüssig ? Schmelz- und Siedepunkt hängen primär von der letzten Elektronenschale ab, ob diese 0, 1 oder 2 Elektronen hat.3g) Schmelzpunkt und Längenausdehnung
Das Produkt aus Schmelzpunkt (K) und Längenausdehnungskoeffizient (bei Wärmeänderung) liegt bei nahezu allen Elementen sehr eng beieinander. Die Schwankungen belaufen sich etwa auf den Faktor 2. Ist der Schmelzpunkt hoch, so ist die Längenausdehnung klein und umgekehrt. Der Abstand zwischen den Mittelpunkten 2er gleicher fester Atome ist bei niedrigem Schmelzpunkt verhältnismässig hoch (nicht immer). So braucht Blei (82e) bei Raumtemperatur etwa den 2-fachen Raum pro Atom wie Iridium (77e).3h) Eisen und sein Rand
Die Gravitation verursacht beim Wiedererstarren von Eisen das Einklinken bzw. somit indirekt die feste Atombindung. Wiedererstarren ohne Gravitation liefert gasförmiges Eisen bei niedriger Temperatur ! Fe-Atome sind am Rand noch negativ und wechseln dahinter sehr schnell auf positiv. Es kommt darauf an, wie viele Minos bzw. welche Wellenlängen diese am Rand haben. Der negative Rand kann daher sehr früh enden (Fe) aber auch sehr weit nach aussen reichen (Cu).3i) Allgemeines zu ‘Nur 1 Elektron in Endschale’
Atome mit nur 1 Elektron in der letzten Elektronenschale binden sich gegenseitig mitunter recht fest (anders als ihre Elementnachbarn meistens). Bei diesen Atomen hat das Atom am Ende der letzten Elektronenschale einen sehr hohen Radius und der Abstand zum nächsten Atom wäre sehr niedrig. Aber das 2. Atom klinkt seitlich (positive Seite) zur Laufbahn des äussersten Elektrons (negative Seite) des ersten Atoms ein. Seitlich klinkt es tiefer ein.3j) Effekte bei nur 1 Elektron in Endschale
Bei Langwellern genügt relativ wenig Minos-Masse um die positive Differenzkraft aus dem Atominneren am Atomrand auszugleichen. Aber die brauchen entsprechend mehr Raum. Bei zB 2-fachem Abstand vom Atomkern (zB etwa H contra He) und zB ¼ dortiger Kraft bräuchten Minos gleicher Qualität und bei gleicher Minosmenge den 8-fachen Raum, d.h. die 2-fache Tiefe bzw. Breite. Bei grösserer Wellenlänge der Minos geht die Anzahl (Masse) zurück. Atome mit nur 1 Elektron in der letzten Schale haben im Verhältnis die geringste Minosmasse und -menge, dafür Langwelligere.3k) Ergebnis bei nur 1 Elektron in Endschale
Bei nur 1 Elektron in letzter Schale erreicht man mit viel weniger Schalen die Grenze zum nächsten angedockten Atom. In diesen Schalen halten sich noch wenig kurzwellige Minos auf (Die Wellenlänge ist etwa proportional zum inneren Radius r der Minos, Kraft wirkt quadratisch zum r). Will man besonders eng angeordnete Materie schmelzen, so braucht man so kurzwellige oder noch kurzwelligere Minos, wie sie sich in diesem Bindungsbereich aufhalten. Mit einem Feuerzeug kann man zB keinen Panzer schmelzen. Das Feuerzeug produziert zu langwellige Wärme. Es setzt zu langwellige Minos frei, welche nicht bis zum entsprechenden Metall-Bindungsbereich vordringen. Gebündeltes Laserlicht aus viel kurzwelligeren Minos kann in die Zwischenräume dieser Atome eindringen und die Atombindung dehnen und schliesslich auflösen.4. Kräfte und innere letzte Elektronenschale der Nukleonen
. . zu 2. . . zu 3. . . zu 5. . . zu 6. . . zum Inhaltsverzeichnis. . Zum Anfang
4a) Nukleon bzw. Atom nach aussen positiv und negativ zugleich
Elektronen und Protonen haben starke Kräfte. Aufgrund durchschnittlich grösserer Entfernung der Elektronen und ihrem Winkel gegenüber ferneren Bezugsflächen bewirken diese Starken nach aussen eine positive Kraft (Negative N sinkt, dadurch entsteht vom Nukleonenkern bzw. dem Atomkern ein positiver N-Überschuss). Diese positive Differenzkraft zieht alles Negative an. Viele ankommende Negative stauen sich vor der äussersten Elektronenschale. Am Atomkernrand bzw. dem Atomrand bauen sich somit durch die sich ansammelnden Minos negative Kräfte, die vom Rand nach aussen wachsen. Dieser Atomkern bzw. das gesamte Atom wirkt dann nah aussen (am Rand) negativ (hohe Minosanzahl mit kurzer Reichweite) und nach weit aussen positiv (weitreichende positive Differenzkraft aus dem Kern überflügelt die kurzweitige des Randes).4b) Kraftumkehrungen von Nukleonen
Die Verhältnisse von Nukleonen, Alfateilchen (Alfas) und den meisten Atomkernen sind extrem stabil. Nur unter ganz genauen Bedingungen lassen sie sich verändern.4c) Alfas
Alfateilchen bestehen aus in einer Ebene liegenden 2 Protonen und 2 Neutronen. Die 2 Protonen stossen sich gegenseitig ab und die 2 Neutronen stossen sich gegenseitig ab. Proton und Neutron ziehen sich in einem bestimmten Entfernungsspektrum gegenseitig an. Beide Neutronen docken an beiden Protonen an. Die beiden Protonen sind etwas weiter auseinander. Daher sind Alfas etwas ovalförmig. Die Protonen haben deshalb gegeneinander über den 1,41-fachen Abstand als zu ihren Neutronen. Komplette Alfas können sich auch aneinander binden. Auch sie haben rundherum Schalen voller Minos. Ihre Äussersten überlappen sich nach dem Andocken. Alfas bzw. ihre Protonen stossen sich gegenseitig stark ab, wogegen sich die Neutronen nur schwach abstossen. Deshalb befinden sich die Alfas und eventuelle weitere Protonen bei grossen Atomkernen wegen ihrer höheren mittleren Kraft gegenüber Neutronen aussen auf einer Kugeloberfläche und die zusätzlichen Neutronen unterhalb dieser Alfas.4d) Abstand von Protonen und Neutronen
Bei Neutronenaufnahme gibt der Kern und das neue Neutron durchschnittlich insgesamt eine Masse von 1% eines ganzen Nukleons ab (Massendefekt). Das ist der Anteil an Minos, der bei der Schalenüberlappung beim Andocken frei wird. Daraus lässt sich die tatsächliche Grösse der Minosmasse am Atomrand sehr eingrenzen. Die Nukleonen sind durchschnittlich etwa 1,8 mal ihres Durchmessers auseinander. Das entspricht im Verhältnis etwa dem durchschnittlichen Abstand von festen Atomen zueinander.4e) Elektronenrotation innerhalb Nukleonen
Die Nukleonen haben im Inneren einen mehrfach starken positiven Kern aus Positronen. Bei Neutronen kreisen genau so viele Elektronen mit riesiger Geschwindigkeit um diesen mehrfach stark positiven Kern.4f) Letzte Schale innerhalb eines Nukleons
Auch innerhalb des Nukleons kreisen die Elektronen vorwiegend als Pärchen. Deren Bahnradien sind sehr dicht beieinander, wobei die Schalen zwischen 2 Pärchen viel weiter auseinander sind. Entsprechend haben wir am Rand das Problem, dass sich dort 1 oder 2 Elektronen in der äussersten Schale befinden. Gibt ein Nukleon nach aussen ein Elektron ab, so hat seine letzte Schale entweder 1 oder 2 Elektronen. Nun hat ein Neutron aber viel mehr Masse als ein Elektron und ein Proton zusammen. Das Minos-Schalensystem am Neutronenrand ist somit mächtiger bzw. kurzwelliger.4g) Vergleich letzte E-Schale Atom - Nukleon
Am Atomrand haben wir das Phänomen, dass Edelgase am Rand verhältnismässig langwellig, rein 1-Wertige etwas kurzwelliger und Atome, welche 2 Elektronen in der äussersten Schale haben, aussen noch kurzwelliger sind. Entsprechend auf den Nukleonenrand übertragen, müsste ein Neutron vielwertiger bzw. am Rand kurzwelliger sein als ein Proton. Dann hat ein Proton am Rand nur 1 Elektron in der 'letzten Bahn'. Dieses hat einen höheren Bahnradius und kann ungestörter kreisen. Beim Neutron wären die Laufbahnen der 2 äussersten Elektronen extrem eng beieinander. Sie zwingen sich zu laufenden gegenseitigen Bahnänderungen. Schliesslich kann das eine das andere unter bestimmten Bedingungen leicht nach aussen schiessen (Nukleon wird zum Proton).4h) Proton mit 1 Elektron aussen
Masse und Bindungsfreude am Nukleonenrand lässt auf die letzte innere Elektronenbahn zurückschliessen.4i) Wertigkeit von Nukleonen
Protonen können 2 Neutronen andocken lassen, aber keine Protonen. 1 Neutron kann bis zu 2 Protonen andocken lassen, aber kein Neutron. Im Vergleich zu Atomen wären Protonen und Neutronen 2-wertig. Beim Andocken von 2 Neutronen an 1 Proton (Tritium) oder 2 Protonen an 1 Neutron (3er He) haben wir denselben Effekt wie beim Andocken von 3 O-Atomen zu Ozon (nur ½ Tiefe).4j) Allgemeines zu Neutron und Proton
Im Neutron kreist ein eingefangenes Elektron mehr als im Proton. Beim Proton fehlt 1 Elektron. Das Elektron kreist im Randbereich des Neutrons (zB 340 mal) schneller als in der externen Elektronenhülle des Atoms. Protonen gibt es bei den Nukleonen nur am Rand des Atomkerns, da sie sich gegenseitig mit starker Kraft abstossen. Elektronen springen nicht zwischen Nukleonen hin und her.5. Bindeschalen der Nukleonen
. . zu 3. . . zu 4. . . zu 6. . . zu 7. . . zum Inhaltsverzeichnis. . Zum Anfang
5a) Umkehrschalen am Neutronenrand
Innerhalb von Neutronen rasen die letzten 2 Elektronen kreuz und quer. Daher wirkt das Neutron ausserhalb dieser letzten Elektronenbahn sehr ausgeglichen, sofort positiv und zieht alles Negative an. Die rotierenden Elektronen halten mit ihrer starken negativen Energie ankommende Negative (wenn genügend kräftig) ausserhalb ihrer kugeligen Bahnoberfläche. Dort baut sich eine Schale gefüllt mit negativen Minos auf. Diese Minos wirken negativ und bauen ausserhalb eine negative Umkehrschale auf. Davor stauen sich wieder Minos, welche wieder eine Umkehrschale aufbauen, usw. Am Neutronenrand baut sich so ein Umkehrschalensystem wie am Atomrand auf.5b) Umkehrschalen am Protonenrand
Am Protonenrand rast das eine äusserste Elektron ohne Bahnrichtungsänderung um den Nukleonenkern. Daher wirkt das Proton in dieser Laufbahn zuerst negativ und nach 1,1 bis 1,2-fachem Bahnradius dieses letzten Elektrons erst positiv. An den 'leeren Seiten' des Protons ist es direkt nach der vorletzten Elektronenschale schon positiv. Es bauen sich die gleichen Minosschalen hinter der letzen Elektronenbahn auf wie beim Neutron, nur anfangs etwas ovalförmiger. Das Proton hat aber nach weit aussen eine viel stärkere positive Kraft als wie obiges Neutron. Deshalb sinkt die zuerst schwächere positive Kraft am Protonenrand viel langsamer. Wegen der geringeren Kraftspitze füllen sich diese Schalen viel langwelliger, haben daher weniger Masse und reichen sehr viel weiter nach aussen.5c) Bindeschalen a / b der Nukleonen
Sowohl Neutron als auch Elektron wirken aufgrund ihrer Differenzenergie aus dem positiven Positronenkern und den Bahnradien der Elektronen nach aussen positiv. Wie oben schon erklärt ziehen beide von aussen schwache Negative an, welche durch die letzten 1 bzw. 2 Elektronen gestoppt und auf Distanz bzw. auf einer Parkposition am Nukleonenrand gehalten werden. Dort baut sich eine erste Schale aus Minos auf (Schale 1a). Die negativ gefüllte Schale wirkt negativ und bildet ausserhalb eine negative Umkehrschale 1b. Dahinter stauen sich wieder Minos zur 2a-Schale, welche eine Umkehrschale 2b bilden, usw. Diese Schalen mit negativen Schwachen nennen wir die Bindeschalen der Nukleonen.5d) Umgebungsunterschied Atom- und Nukleonenbindung
Die ‘Gasförmigkeit’ von Atomen hängt vor allem von der Wertigkeit ab und zweitens wieviel Minos-Energie es am Rand momentan besitzt. Bei Nukleonen finden wir auf der Erde fast nur tiefe Wertigkeitsbindungen. Flachere Bindungen sind bereits die Alfabindungen. An der Erdoberfläche finden wir einen gravitations- und druckbedingten Überschuss an Minos, der über 0 K liegt. Im Wellenlängenbereich der Minos an den Nukleonenrändern existiert an der Erdoberfläche kein druck- oder gravitationsbedingter Überschuss an Minos. Auf den Atomkern übertragen könnte man dort von Verhältnissen um 0 K sprechen.5e) Überschuss an Kernminos in Muttersternen
Um so kurzwelliger, um so weiter können Minos zum Atomkern, Alfas, Nukleonen und Nukleonenkerne vordringen und dortige Schalen noch kurzwelliger machen. Der Mensch kann die 'Temperatur' am Kernrand nur ändern indem er andere Nukleonen zuführt oder eine Umgebung wie bei der Kernspaltung bzw. Kernfusion verursacht. Bei anderen Umgebungen wie in der Sonne oder Muttersternen sind sehr leicht Umgebungen des Atomkerns vorstellbar, die nicht bei '0K' liegen. Es herrscht mitunter ein hoher gravitationsbedingter (im Sterninneren) Überschuss an passenden kurzwelligen Minos, welche die Alfa- und Nukleonenbindungen aufbrechen. Ausserdem bremsen diese die Elektronen um den Atomkern. Ein frühes Einfangen ist die Folge. Solche Sterne werden zunehmend zu Neutronensternen.5f) Bindungskurve der Nukleonen
Bei 'Null K' am Nukleonenrand stossen sich freie Nukleonen ab bestimmter naher Entfernung gegenseitig positiv ab. Kommen Minos hinzu, so sinkt die Abstossung zunehmend und die Linie der Kraftumkehrung auf positiv verschiebt sich immer weiter nach aussen. Sind 2 Nukleonen ineinander eingeklinkt, so bleiben sie das bei '0 K'. Bei Minoszufuhr kann die Bindung anfangs sogar besser werden und dann wieder schlechter. Die Festigkeit und sonstige Eigenschaften der Nukleonenbindung hängt massgeblich von der Qualität der beteiligten Minos ab. Bei einer bestimmten Menge an jeweiligen Wellenlängen ist die Bindung am besten. Jenseits davon geht die jeweilige Bindungskurve nach unten. Wir erhalten von der minimalsten Bindung mit den wenigsten bzw. schwächsten Minos über das Bindungsmaximum bis hin zum Gaszustand eine von der Minosenergie abhängige Bindekurve.5g) Neutronen sind keine Gase - bei genug Entfernung stossen sich alle Grossen ab
Neutronen liefern kein rein gasförmiges Verhalten (reagieren mit Protonen wie F mit H). Weit genug auseinander stossen sich Neutronen gegenseitig ab (auch alle Atome). Neutronen wirken nach aussen bei mittlerer Entfernung negativ (negativer Rand wirkt viel weiter als bei Protonen), danach weiter aussen positiv ! Die starken Teile des Neutrons (Positronen, Elektronen) liefern die positive Differenzkraft bei genügend Entfernung nach aussen. Beim Proton fehlt zwar ein Elektron, aber es hat die gleiche positive Kraft aus dem Nukleonenkern, ein änliches Schalensystem wie die Neutronen und wirken dahinter früher und stärker positiv.5h) Negative Suppe des Nukleonenkerns
Im Zentrum hat jedes Nukleon einen Kern aus 100 bis 200 Positronen, die sich auf einer Kugeloberfläche aufhalten. Sie werden durch eine riesige Masse sehr kurzwelliger Minos zusammengehalten. Die negative Suppe des Nukleonenkerns aus Minos ist negativ. Sie schwächt die positive Kernwirkung über die riesige Entfernung zum äusseren Elektronenrand (*105) nur minimal, da diese schwach ist und nur eine sehr kurze Reichweite hat. Sie hält auch die innersten Elektronen mit auf Distanz. Auswirkungen auf die Bindeschalen der Nukleonen sind daher unbedeutend.6. Massenfluktuation + Aggregatszustand von Nukleonen
. . zu 4. . . zu 5. . . zu 7. . . zu 8. . . zum Inhaltsverzeichnis. . Zum Anfang
6a) Massenverhältnisse an Kern- und Atomrand schwer eingrenzbar
Massenmässig lässt sich der Nukleonenrand nicht vom Atomrand herunterrechnen oder umgekehrt. Die Kraft ist höher, das Volumen kleiner. Der Atomkern hat nach aussen starke Kräfte (positive Urladungen Überschuss), wogegen der Atomrand seine Kraft nur aus der Radien-Differenzenergie aus gleichviel positiven und negativen Urladungen bezieht. Daher können sowohl der Nukleonenkern aus Positronen als auch der Atomkern extrem kurzwellige Schwache in ihr Schalensystem aufnehmen. Entsprechend mehr Masse zieht der Atomkern in seine Schalen. Um wieviel die durchschnittliche Wellenlänge der Minos am Kernrand kleiner ist als am Atomrand lässt sich noch nicht ermessen. Sie könnten dabei auch um bis zum 10 Mrd-fachen kürzer sein.6b) Massenverluste
Beim Elektronenverlust eines Neutrons verliert das Neutron eine Masse an Schwachen, welche etwa 0,087% der Gesamtmasse eines Neutrons ausmacht. Macht die Masse der Schalen um das Nukleon etwa 9% der Gesamtmasse des Nukleons aus, so verliert das Neutron beim Elektronenverlust weniger als 1% dieses Schaleninhalts. Bei Aufnahme von Neutronen durch den Atomkern verliert das Neutron durchschnittlich 1% der Gesamtmasse bzw. nach obiger 9%-Annahme etwa 1/9 seiner äusseren Schalenmasse. Wenn ein Atomkern ein Nukleon aufnimmt, so ist es ähnlich, wie wenn 2H und 1O zu Wasser verbrennen (vgl. auch Kernfusion). Wenn ein Neutron am Rand des Atomkerns nur tanzen würde, so hätte es kaum Massenverluste.6c) Massendifferenz von Proton/Neutron unproblematisch
Neutronen haben innen einen kleineren Durchmesser als die Protonen. Die Neutronen-Bindeschalen haben aber nur minimal mehr Kapazität (verliert bei Elektronenaustritt nur 0,087% der Nukleonenmasse). Da die Nukleonen um etwa ihren 1,8-fachen Durchmesser auseinander sind, machen diese Unterschiede nichts aus. Zwischen den Kraftumkehrungen der Bindeschale ist bei Proton und Neutron nur wenig Unterschied.6d) Kraftdifferenz-Entwicklung bei Proton und Neutron weiter weg
Der Unterschied zwischen Neutron und Proton ist derjenige, dass das Proton einen und das Neutron keinen Überschuss an starken Urladungen hat. Die schwache Kraft der Neutronen fällt nach aussen schneller als die Starke der Protonen. Bei 1/10³-fachem Abstand fällt die starke Kraft auf 1/10³, wobei die Schwache auf etwa 1/109 fällt. Daher wirkt das Proton auf grössere Entfernung wieder stark positiv, wobei das Neutron lange schwach negativ bleibt. Bei zB 6 Elektronen in äusserster Atom-Schale wäre bei 6 starken Positiven (Kraft +6) im Nukleon-Zentrum die starke Kraft an der Stelle eines Elektrons bis +4,5 stark.6e) Alle Ränder sind negativ und voll
Ein Neutron würde von weitem am liebsten ein Elektron, am Rand dann lieber ein Positron aufnehmen. Aber alle grossen 'Positiven' sind am Rand auch negativ. Es müssen die Wellenlängen am Rand zueinander passen, wenn Neutronen bzw. Protonen aufgenommen werden sollen. Es entscheidet nicht die Menge, da der Atom- bzw. Nukleonenrand sowieso immer voll ist.6f) Aggregatszustand der Nukleonen
Die Nukleonen sind innerhalb den Alfas gegenseitig relativ fest gebunden (tiefe Wertigkeitsbindung). Die Alfas und die übrigen Neutronen dagegen sind im Atomkern aber gegenseitig weder fest noch gasförmig. Die Alfas sind gegeneinander leicht beweglich auf einer Kugeloberfläche plaziert. Ihre Oberfläche verhält sich wie ein schwach aufgepumpter Ball.6g) Letztes Nukleonen-Elektron: Allgemeines zur Schale
Innerhalb des Nukleons kreisen viele Dutzend Elektronen mit 100- bis 1000-facher Geschwindigkeit. Deshalb können Schwache fast nicht zum Kern aus Positronen durchdringen, es sei denn sie sind schwach genug bzw. ihr Impuls ist genügend hoch. Der Nukleoneninnenraum und der Nukleonenkern ist sehr geschützt.6h) Zerstrahlung und Neubildung von Starken
Die äussersten letzten 1 bzw. 2 Elektronen innerhalb des Nukleons halten die äusseren Minosschalen des Nukleon auf Abstand. Dadurch werden diese Elektronen immer langsamer und nach so und soviel Mrd- oder Bill. Jahren eingefangen. Das Elektron und ein Positron des Nukleonenkerns zerstrahlen dann. Ihre Minos rasen dann nach aussen und können wieder langwellige 4er-Teilchen zerreisen und erneut Elektronen und Positronen aufbauen.7. Elektronenaustritt
. . zu 5. . . zu 6. . . zu 8. . . zum Inhaltsverzeichnis. . Zum Anfang
7a) Positiver Neutronenkern zieht fremde Elektronen an
Das Ausklinken des letzten Elektrons aus einem Nukleon hängt mit der Bindung eines 2. Neutrons zusammen. Die positive Anziehungskraft der Nukleonen zieht deren äussere Elektronen gegenseitig kräftig an. Ist das Schalensystem eines ankommenden neuen Neutrons zu schwach (zB zu kurzwellig), so wirkt die negative Abstossung weniger und beide Neutronen klinken viel tiefer ineinander ein.7b) Entstehen eines Protons
Die äussersten Elektronen kommen sich mit 300-facher Geschwindigkeit um das 100.000-fache näher als entsprechende Elektronen bei der Molekülbindung am Atomrand. Nun kommt es darauf an, wie nahe sich diese Elektronen kommen. Ab einer bestimmten Entfernung ist ein Elektron der je 2 äusseren Elektronen zuviel. Wird eines von einem anderen aus der Bahn gedrängt und rast nach aussen, so entsteht ein Proton. Ist das Schalensystem eines ankommenden Neutrons kräftig bzw. negativ genug (heisse Neutronen), so bleiben beide weit genug auseinander. Der Einfluss der gegenseitigen Elektron bleibt gering und kein inneres Elektron wird nach aussen katapultiert.7c) Positiver Elektronenrand gefährdet Stabilität
Jedes Elektron hat einen positiven Rand (aus Milliarden von Plusos). Dahinter wirkt das Elektron erst ab einer bestimmten Entfernung stark negativ, wenn die lange Kraftreichweite der überschüssigen starken negativen Urladung die kurze Kraftreichweite der Plusos überflügelt hat. Die starke negative Kraft der äussersten 2 Elektronen hält das Minos-Schalensystem auf einer Parkposition am Neutronenrand. Gerät ein Elektron schlagartig zu nah an diesen Rand, so reicht der positive Elektronenrand an das nagative Schalensystem und wird hineingezogen. Das Elektron hat nun keine Chance mehr, auf seiner Bahn zu bleiben.7d) Trägheit der Minosschalen wichtig
Die Trägheit des Schalensystems spielt hier eine Rolle. Die Minos dieser ersten Schalen sind sehr kurzwellig und haben somit extrem wenig Energie. Kommt ein Elektron von innen 'langsam' in die Richtung dieser Minos, so drückt es diese Minosschalen entsprechend stark negativ etwas nach aussen. Sie können den positiven Elektronenrand nicht erreichen.7e) Elektronenausklinken durch Kurzwellenzufuhr
Die äussersten 2 Elektronen sind in ihrer Bahn normalerweise extrem stabil. Um ein Elektron herauszulösen ist in unserer Umgebung zwingend der Einfluss weiterer Starker nötig (andere Elektronen bzw. Nukleonenkerne). Man muss nur versuchen, die negative Abstossung zwischen den Neutronen zu verringern. Wird der Rand des Neutrons durch Zufuhr Kurzwelliger und damit Verdrängen Langwelliger immer kurzwelliger, so sinkt die negative Energie des Neutronenrandes und seine Masse steigt. Um so mehr die negative Abstossung fällt, um so näher drücken sich die inneren Neutronen zusammen, bis sich die eingeklinkten Schalen von 2 Neutronen so nahe kommen, dass 1 Elektron aus dem Inneren nach aussen rast.7f) Elektronenausklinken mit mittleren Wellen
Beta-Minus-Reaktionen kommen in der Natur unter genau bestimmten Bedingungen laufend vor. Die Bedingungen, unter welchen ein Neutron das äussere Elektron verliert, lassen sich noch viel weiter eingrenzen. Kommen zum Atomkern sehr mittelwellige Minos (Kern hat kurz- und langwellige Minos der Grösse 3), welche die mittleren Schalen des Nukleons weniger negativ machen (durch Verdrängung noch Negativerer), so ziehen diese das äusserste innere Elektron indirekt nach aussen. Sind die ankommenden Minos zu kurzwellig, so erhöhen sie nur die Abstände der Schalen zwischen den 2 Neutronen und stabilisieren das letzte Elektron sogar.8. Sonstiges
. . zu 6. . . zu 7. . . zum Inhaltsverzeichnis . . Zum Anfang
8a) Energie und Kraft oft proportional
Bei 4-facher Protonenzahl hat man bei gleichem Abstand die 4-fache Kraft nach aussen, aber nur den 4-fachen Druck. Bei 4-fachem Druck hat man die 4-fache Kraft auch nur die 4-fache Energie ! Vorsicht: In vielen Fällen wie bei Strömungen braucht man für die 4-fache Kraft die 8-fache Energie (Geschwindigkeitsänderungen erforderen das). Kraft und Energie können aber auch proportional laufen, anstatt 4/8 ! Bei 8-facher Protonenzahl hat man die 8-fache Energie, Kraft und Druck nach aussen. Die Fläche und der Abstand haben sich dabei nicht verändert.8b) Durchschlüpfen durch Sperrschalen
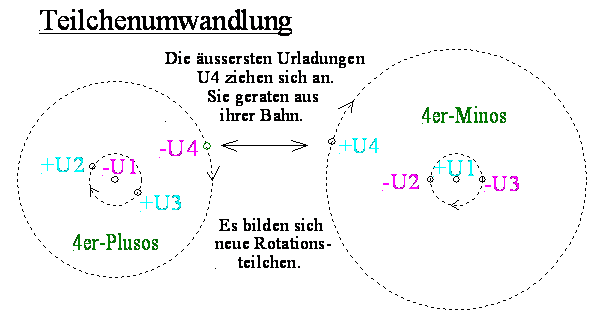
Die Differenz der Minusschalen zwischen Proton und Neutron ist um so kleiner, je mehr Elektronen am Rande des Nukleonenkerns rotieren. Um so mehr rotieren, um so ‘kleiner’ müssten diejenigen negativen Teilchen sein, welche in den Innenraum des Nukleons durch diesen Elektronengürtel hindurch wollen. Nur Teilchen ab einem bestimmten Impuls im Verhältnis zu ihrer Kraftwirkung können in den Innenraum eindringen. Dasselbe gilt für alle Minos und alle sonstigen Starken und Schwachen (wie zB ganze Atome). Bei Atomen sind diese Teilchen entsprechend grösser, bei den Nukleonen entsprechend kleiner.8c) Teilchenumwandlung
Minos in der Minusschale reagieren mit ankommenden Plusos (positive Schwache). Die Positiven werden umgedreht und in Minos verwandelt. Die Plusos und Minos reagieren so lange miteinander, bis nur Minos übrig bleiben.