zum Inhaltsverzeichnis . .
Vieles wird dabei als bekannt vorausgesetzt.
Falls dem Leser Vorkenntnisse fehlen, wird auf
folgende Schriften verwiesen:
Gravitation1
- - Gravitation bzw.
nahe Astronomie - - Weite Astronomie
- - Wasser
- - Erdzeitalter, Erdgeschichte
- - Erd- und
Planetenentwicklung - - Mondeinfang
- - Licht und Klimakatastrophe - - Atmosphärischer Nukleonenumbau - - Lichtfarben und -geschwindigkeit
Astronomie, Elektro, Lehre, Kerne, Kraft, Spezielles, Strahlen, Teilchen
Im folgenden
werden die Teildokumente zur Astronomie abgehandelt
1) Struktur und Energie
des Wassers
1b) Energiefreisetzung beim Dipol – 2. Schalenüberlappung bei H
1c) Moleküle positiv / negativ
1d) Kurzwellen- bzw. Wärmezufuhr bei Wasser
1e) Wegnahme Kurzweller senkt die Negativität
1f) Mehr Moleküle pro l – mehr Gravitation
1g) Zu kurzwellige Zufuhr - biologische Gefahr
2b) Keine weiteren H-Atome eng andockbar
2c) Wasser an den Stirnseiten weniger positiv
2d) H-O- Verbindung extrem eng
3a) Minoszufuhr – manchmal Raumverengung
3b) Wasser – Gewicht und Raumbedarf bei 4°C
4a) Wärmetabelle von Wasser: 0 - 8°C
4d) Wasser bei 0°C am O positiv
4e) Stellungsänderung beim Gefrieren
4g) Erwärmung: Raumbedarf contra Gravitation
4h) Festigkeit Atome / Moleküle, Gewichtskraft / Raumbedarf
4i) Kraft- und Raumentwicklung laufen nicht proportional
5a) Wasseroberfläche – viel weniger gebunden
5e) Fallender Luftdruck lässt Wasser regnen
6b) Minusüberdruck oberhalb 0 K
6c) Kalte / warme Autobatterie
6d) Wasser und Wärmeminos in Autobatterie
6e) Wärmeverlust induziert mehr Kraft auf die Elektroschalen
6h) Minustemperatur bei Fe und Wasser
6i) Ultradünne Wasserschichten an der Grenzfläche zu Eis
VI) Wasser
Das ist ein
Dokument zur Astronomie
1) Struktur und Energie des Wassers
zum Inhaltsverzeichnis . . zurück zum Anfang
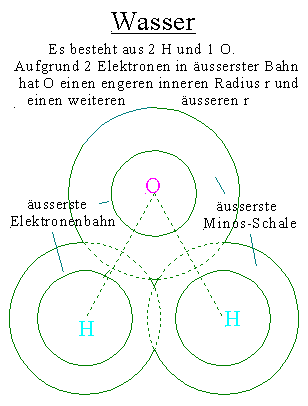
1a) 2 H + 1 O
Beim Verbrennen von 2 H- und 1 O- Atom entsteht Wasser bei enormer Energieabgabe.
Das O- und beide H- Atome verlieren an 2 Seiten einen enormen Minosbetrag (der sich überschneidende Schalenbetrag.
Das führt dazu, dass Wassermoleküle bei gleicher Umgebungstemperatur viel positiver sind, als ihre Einzelatome vorher.
Die H-Atome verlieren langwelligere, das O-Atom kurzwelligere Minos.
1b) Energiefreisetzung beim Dipol – 2. Schalenüberlappung bei H
Oben wurden die 3 Atome in Dipolform gezeichnet.
Hier verlieren auch die beiden H- Atome überschneidende Schalen an 2 Seiten.
 Lägen
die 3 Atome in einer Linie (zylinderähnlich), so würde die H-Atome nur an je 1
Seite Minos verlieren (zum O).
Lägen
die 3 Atome in einer Linie (zylinderähnlich), so würde die H-Atome nur an je 1
Seite Minos verlieren (zum O).
Genau das passiert bei den Bindungen zu H2, O2 und HO !
Der Minosverlust der 2. Überlappung bei H setzt soviel mehr Minos frei, dass wir bei der Verbrennung zu Wasser einen freien Minosüberschuss bekommen gegenüber der Minoszufuhr zum Trennen von H2 und O2.
1c) Moleküle positiv / negativ
Moleküle haben am Rande Schalen voller Minos. Sie sind durchschnittlich etwas langwelliger als die um ihre Atome.
Haben Moleküle zuwenig Minosenergie, so haben sie in bestimmter Entfernung hinter ihrem dem negativen Rand eine Kraftumkehrung auf positiv.
Um so weniger Minosenergie, um so früher sind sie hinter dem Rand positiv und stossen sich ab dort besser nach aussen ab.
Führt man Minos zu, so werden sie immer weniger positiv, bzw. ihr negativer Rand verbreitert sich.
1d) Kurzwellen- bzw. Wärmezufuhr bei Wasser
Bei Zufuhr kurzwelliger Wärme über 4°C braucht Wasser mehr Raum, wobei es aussen auch Langwelligere negativere Minos verlieren kann.
Im Verhältnis nimmt es aber überproportional mehr kurzwelligere Energie auf, als es Langwelligere verliert (überdruckbedingt, bei Abkühlung verliert sie diese wieder).
Entweder ist die ganze Umgebung dabei wärmer oder es kann Aufgenommene nicht schnell genug wieder abgeben. Entsprechend braucht es mehr Platz.
Von grosser Bedeutung ist auch, welche Schalen die neuen Minos aufnehmen. Um so weiter aussen, um so mehr Platz braucht das Atom / Molekül pro zugeführter Einheit.
. . Hat warmes Wasser am äusseren Rand viel Kurzweller aufgenommen, so hat es nicht unbedingt viel mehr negative Energie, es braucht aber viel mehr Platz.
zu Wasser
1e) Wegnahme Kurzweller senkt die Negativität
Man darf bei Raumbedarf und Minusenergie nicht 'Eintopf' machen.
Beim Entfernen von Wärme bei Wassermolekülen wird Wasser immer weniger negativ.
Es verliert dort die meisten Minos, wo der Überdruck am höchsten ist.
Hat man vorher vor allem sehr Kurzwellige zugeführt, so haben wir einen kurzwelligen Überschuss sehr tief unten im Schalensystem. Bei Abkühlung verliert man vor allem diese und weniger jene am äussersten Rand.
Das kann den negativen Betrag nach weit aussen viel besser senken als den Raumbedarf.
. . Raumbedarf und Minoszufuhr bzw. Minoswegnahme laufen nicht proportional zueinander !
1f) Mehr Moleküle pro l – mehr Gravitation
So wie sich Wasser bei Wegnahme von Wärme bis 4°C zusammenzieht, konzentriert es mehr Moleküle pro Liter.
Entsprechend zieht die Gravitation Wasser pro Liter besser nach unten.
Die geringere Minosmenge macht dabei nur einen Bruchteil der höheren Gravitation aus.
Gegenüber der Gravitation (negativer Erdmantel) bleibt Wasser immer positiv (seine Minos negativ).
. . Bei 4°C ist 1 Liter Wasser am schwersten (dichtesten), nicht aber seine einzelnen Moleküle.
1g) Zu kurzwellige Zufuhr - biologische Gefahr
Man kann Wasser in Zentralheizungen mit extrem kurzwelliger Wärme aufheizen.
Dabei kann es passieren, dass sehr viel Wärme von den Atomschalen des Wassers anstatt von den Molekülschalen aufgenommen wird.
Die interne Wasserbindung kann dabei aufbrechen und H wird frei.
Freier H kann überall mit andocken und auch beim Menschen zu erheblichen biologischen Störungen führen.
2) Molekülanordnung
zum Inhaltsverzeichnis . . zurück zum Anfang
2a) Molekülreihen
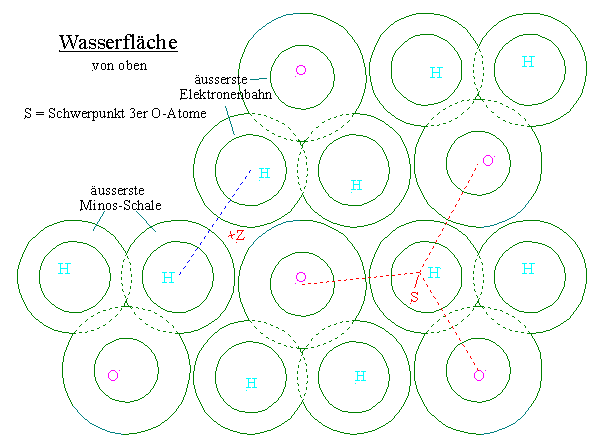
Unteres Bild zeigt eine 2-dimensionale Reihe an Wassermolekülen nebeneinander.
Die Moleküle der nächstoberen Reihe können sich nicht genau über einem unteren platzieren.
O-Atome ordnen sich auch nicht genau auf bzw. unter einem anderen O-Atom an, sondern daneben.
Die H-Atome eines Moleküls sind enger beieinander als die H-Atome zwischen 2 Molekülen.
Die nächste Reihe O-Atome setzt sich immer genau in die Richtung zwischen 2 weit auseinander liegenden H-Atomen der Reihe darüber bzw. darunter (unten etwa auf den Punkt Z).
zu Wasser
Es gibt stellen, wo 2 O-Atome sehr eng beieinander liegen, und zwar O-Atome zur darüber bzw. darunter liegenden nächsten Reihe. Diese verursachen die Raumproblematik des Wassers bei 0 bis 4°C.
2b) Keine weiteren H-Atome eng andockbar
Die Entfernung zwischen dem O-Atom eines Moleküls und den H-Atomen eines 2. ist etwas kleiner als die zwischen den H-Atomen benachbarter Moleküle.
Die H-Atome benachbarter Moleküle können nicht so nah heran, da die Laufbahnen ihrer Elektronen verstärkt in die Richtung ihres eigenen zugehörigen O-Atoms gerichtet sind.
Diese Elektronen stossen sich entsprechend nach hinten (zu H-Atomen benachbarter Moleküle) ab, so dass keine enge Bindung zu den hinteren Nachbarn mehr möglich ist.
Dasselbe passiert auf der ‚leeren’ Rückseite des O-Atoms, wo weitere enge Bindungen ausgeschlossen sind.
2c) Wasser an den Stirnseiten weniger positiv
O-Atome (8 Elektronen) sind am Rand etwas weniger positiv als die H-Atome (je 1 Elektron).
Um das O-Atom bildet sich ein Bereich, der negativer ist.
An der H-Seite des Moleküls ist es etwas weniger negativ.
An der Rückseite des O-Atoms zieht das Molekül viel mehr Minos an.
Trotzdem kann es die bei der Atombindung abgegebene Minusenergie nicht kompensieren. Es fehlt auch dort jede Menge Minosenergie.
Ein Wassermolekül ist an der O-Rückseite am negativsten, an der H-Dipolseite am positivsten.
2d) H-O- Verbindung extrem eng
An einem Wassermolekül dockt ein 2. Wassermolekül mit seinem H-Atom im Bereich des O-Atoms des 1. flach an.
Wassermoleküle haben einen durchschnittlichen Abstand von 2,31*10-10m (Ni 1,58*10-10m, Al 1,81*10-10m).
Wasser besteht aus 3 Atomen. Von 2,31*10-10m ausgehend hätte jedes Wasseratom einen durchschnittlichen Abstand von 1,604*10-10m zu seinen Nachbarn.
2e) Auch Wasser extrem eng
Die Wassermoleküle sind aber viel weiter auseinander als ihre inneren Atome.
Die 3 Atome eines Wassermoleküls sind viel enger beieinander (z.B. 1,45*10-10m) als wie feste Ni- oder Cu-Körper.
Aufgrund der hohen Dichte des Wasser und des hohen Raumbedarfs des Elektrons der H-Atome, liegen die Wassermoleküle im Flüssigzustand extrem eng beieinander.
Auch räumlich optimales nebeneinander schachteln ist nicht ganz möglich. Die Abstände zwischen den Molekülen sind höher.
3) Grösste Dichte bei 4°C
zum Inhaltsverzeichnis . . zurück zum Anfang
3a) Minoszufuhr – manchmal Raumverengung
Sind 'kalte' positive Moleküle nicht alleinstehend sondern zusammen (z.B. fest, flüssig), so können sich viele bei Minoszufuhr entsprechender kurzwelliger Wellenlängen zuerst enger zusammen ziehen.
Natürlich werden sie dabei auch weniger positiv.
Ab einer bestimmten Minosenergie brauchen sie das kleinste Volumen und dehnen sich bei weiterer Wärmezufuhr wieder aus.
3b) Wasser – Gewicht und Raumbedarf bei 4°C
Bei Zufuhr kurzwelliger Wärme wird warmes Wasser negativer (bzw. weniger positiv), braucht mehr Raum und reduziert bei sich die anziehende negative Gravitation des Erdmantels und steigt schliesslich auf (Wärmeströmungen im Wasser bzw. und Verdampfung an der Wasseroberfläche).
Erwärmt man Wasser ab 4°C oder kühlt man es herunter, so dehnt es sich beide Male aus.
Die Wassermoleküle stossen sich bei 4°C am wenigsten auseinander.
. . Die Erdgravitation zieht bei 4°C nicht unbedingt am stärksten, sondern der H2O- Raumbedarf ist am kleinsten !
Hier ist es am 'schwersten', weil es die meisten Moleküle pro Liter hat, und nicht weil es dort vielleicht am positivsten wäre.
3c) Wasser um 4°C
Die Wassermoleküle sind bei 4°C am nahesten beieinander.
Hier haben sie zum Erdmantel pro Molekül eine bestimmte Gravitationskraft.
Bei Zufuhr negativer Wärmeenergie müssten sie sich vom negativen Erdmantel gravitationsmässig nicht mehr so anziehen lassen. Sie werden negativer und drücken sich weiter auseinander.
Bei Wegnahme von Wärmeminos auf unter 4°C müssten sie wegen weniger negativer Energie schwerer werden. Allerdings brauchen sie dann mehr Platz und haben weniger Moleküle pro Liter.
zu Wasser
3d) Wasser unter 4°C
Nimmt man Wasser mit 4°C viele Minos weg (Abkühlung), so sinkt der negative Kraftanteil.
Trotzdem bzw. gerade deshalb dehnt sich Wasser nun aus !
Die durchschnittliche positive Abstossung zwischen den Molekülen überflügelt nun die Minoskraft zwischen ihnen.
Werden bei Wärmewegnahme zuerst die H-Atome des Wassers positiver ?
4) Gefrieren - Festigkeit
zum Inhaltsverzeichnis . . zurück zum Anfang
4a) Wärmetabelle von Wasser: 0 - 8°C
Nimmt man Wasser mit 4°C Wärme weg, so dehnt es sich erst nur ganz minimal aus.
H2O mit 20°C hat 0,998 205 kg/dm³
H2O mit 16°C hat 0,998 943 kg/dm³ (...738 Differenz zu 20°C)
H2O mit 12°C hat 0,999 498 kg/dm³ (...555 Differenz zu 16°C)
H2O mit 8°C hat 0,999 849 kg/dm³ (...351 Differenz zu 12°C)
H2O mit 6°C hat 0,999 941 kg/dm³
H2O mit 4°C hat 0,999 973 kg/dm³ (...124 Differenz zu 8°C)
H2O mit 2°C hat 0,999 941 kg/dm³
H2O mit 0°C hat 0,999 841 kg/dm³
Eis mit 0°C hat 0,917 kg/dm³ (8,3% mehr Volumen bzw. 2,7% Ausdehnung)
4b) Beschreibung der Tabelle
Bei 0 und 8°C hat Wasser etwa die gleiche Dichte.
Dazwischen steigt sie um maximal 0,013 %.
Wassermoleküle sind dort etwa 0,0043 % näher beieinander.
Über 8°C geht Wasser viel schneller auseinander.
Die Bildung von Eis führt zu einer deutlichen Ausdehnung.
Beim Ausdehnung wird die Verbindung zwischen den Molekülen hier fest anstatt gasförmig.
4c) Gefrieren
Beim Gefrieren dehnt sich Wasser/Eis kräftig aus.
Das liegt daran, dass die negative Abstossung an der O- Rückseite sinkt.
Dabei zieht es die O-Atome zu den noch H-Atomen des angrenzenden Nachbar-Moleküls näher hin !
Das O der darüber liegenden Ebene zieht es bei Wärmewegnahme auf die 2 darunter liegenden H-Atome hinauf.
Deshalb brauchen die Moleküle nun um 2,7% mehr durchschnittlichen Durchmesser.
Die Verbindung zwischen dem O-Atom des 1. Moleküls und den 2 H-Atomen des 2. Moleküls wird fest.

zu Wasser
4d) Wasser bei 0°C am O positiv
. Um so extremer Molekülränder plus- minusmässig auseinander sind, um so näher ziehen sie einander an !
Wasserstoff hat nur 1 Elektron in der äussersten Schale, Sauerstoff 2 und 6 weiter innen.
O ist daher viel negativer und aussen viel kurzwelliger.
Das betrifft somit vor allem die O-Rückseite des Wassermoleküls.
4e) Stellungsänderung beim Gefrieren
Vor dem Gefrieren ist die O-Rückseite zu negativ um sich mit H-Atomen benachbarter Moleküle fest zu binden.
Bei Wärmewegnahme um 0°C beim Gefrieren nähert sich diese O-Rückseite den 2 nächsten H-Atomen immer weiter an.
Schliesslich ziehen diese das O-Atom über sich auf sich hinaus und halten es fest.
Beide Moleküle sind hier nun fest verbunden und brauchen insgesamt mehr Raum.
Beim Gefrieren verändert sich somit die Stellung der Moleküle nebeneinander.
Zuerst liegen sie verschachtelt und schwach gebunden nebeneinander, dann steht jeweils eines auf dem anderen starr.
Das gute nebeneinander Schachteln haben wir hier nicht mehr.
4f) Schmelzen
Ist die Molekülanordnung umgestellt, so dehnt sich Eis bei weiterem Wärmeentzug nicht mehr so aus.
Beim Schmelzen läuft der Mechanismus genau umgekehrt mit einigen Unterschieden.
Beim Schmelzen füllt sich natürlich zuerst der Molekülbereich, der langwelligere Minos aufnehmen kann.
Schrittweise werden dann die Langwelligsten durch immer Kürzerwelligere verdrängt.
Die negative Zufuhr zieht die positiven Moleküle näher zusammen.
Schliesslich fallen die aufgetürmten Moleküle wieder um 2 bis 3 % herunter.
Die feste Bindung zwischen den 2 H-Atomen des einen Moleküls und dem O des 2. bricht auf.
Die Bindungen zu den übrigen Molekülseiten können nun wieder näher zusammen und Wasser braucht viel weniger Raum.
4g) Erwärmung: Raumbedarf contra Gravitation
Bei Erwärmung und negativer Energiezufuhr sinkt einmal die Gravitationskraft jedes Wassermoleküls.
Gleichzeitig werden angrenzende Moleküle weiter weggedrängt (ab 4°C).
1dm³ Wasser wird dabei leichter.
4h) Festigkeit Atome / Moleküle, Gewichtskraft / Raumbedarf
Bei Atomen hängt die Festigkeit von Menge und Qualität der Minos ab.
Die Festigkeit zwischen den Molekülen hängt wie beim Wasser manchmal auch zusätzlich mit von der Stellung der Moleküle ab.
Die Gewichtskraft von Wassermolekülen hat mit der Kraft auf die direkte Umgebung etwas weniger zu tun.
Moleküle brauchen den kleinsten Raum, wenn sie sich gegenseitig am optimalsten aneinander schachteln. Mit der Bindungstiefe des Einzelnen hat das oft nichts zu tun, auch oft nicht mit Neutralität oder Ausgeglichenheit.
Gerade beim minimalen Raumbedarf bleibt Wasser unten (im Meer)!
Die Gravitationskraft pro Molekül steigt, wenn Moleküle noch positiver sind (Minosabgabe).
Dehnen Sie sich dabei aus (Wasser unter 4°C), so können sie trotz höherer Gravitation pro Molekül wegen höherem Raumbedarfs von anderen verdrängt werden und steigen auf.
4i) Kraft- und Raumentwicklung laufen nicht proportional
. Bei Atomen dürften wir bei Minosabgabe 'angrenzender' Wellenlängen normal eine Krafterhöhung in Richtung positiv haben, bei Aufnahme eine in Richtung negativ !
Allerdings ist dieses nicht zu verallgemeinern.
Bei Wasser bzw. anderen Molekülen oder Kristallen führen Stellungsänderungen zu anderem Raumbedarf.
Bei Aufnahme anderer Wellenlängen sind auch extreme Sprünge bei der Kraft- und Raumentwicklung möglich.
5) Regen
zu Wasser zum Inhaltsverzeichnis . . zurück zum Anfang
5a) Wasseroberfläche – viel weniger gebunden
Ist ein Wassermolekül an der Oberfläche, so hat es an der äusseren Hälfte mehr und viel langwelligere Schalen und ist dort negativer.
Bei genügend Wärmemenge dehnen sich Wassermoleküle weit aus. An der Oberfläche betrifft das vor allem den unteren Bereich zu den Nachbarmolekülen.
Wasser ist oft in Bewegung. Demgemäss kommt es laufend höher und tiefer aus dem übrigen Wasser heraus.
Anstatt z.B. zur Hälfte an Nachbarn gebunden zu sein, ist es teilweise noch bis weniger als ¼ an untere bzw. seitliche Nachbarn gebunden.
5b) Verdunstung / Regen
Ist es an der Wasseroberfläche warm genug und kommt es weit genug aus der Wasseroberfläche heraus, so füllt es seinen äusseren Rand dabei mit bis über ¾ voll.
Dann kann es nicht mehr zurücktauchen, da es negativer wurde, bleibt oben, füllt sich rundherum mit Langwellern auf und wird gasförmig.
Es weitet sich so, dass es in Bodennähe pro Gewichtseinheit mehr Raum als Stickstoff- bzw. Sauerstoffmoleküle benötigt.
Es steigt auf und kühlt sich dabei wieder ab. Dann fällt es wieder.
Beim Abkühlen verringert sich die gegenseitige negative Abstossung gasförmiger Wassermoleküle am Molekülrand.
Schließlich ziehen sie sich gegenseitig an, bilden Wassertropfen und fallen als Regen herunter.
5c) Regengrundlage
Wasser 'dreht' sich weniger um die Null-Marke zwischen positiver und negativer Kraft. Es ist sehr positiv.
Beim Aufsteigen ist Wasserdampf am wenigsten positiv.
Es verliert beim Hochsteigen immer mehr Minos (geringerer Luftdruck, weniger Lufttemperatur).
In der Atmosphäre bilden sich bei Abkühlung oben Wassertropfen.
Sinkt der Luftdruck genug, so fallen sie als Regen herunter.
Vorher und dabei ziehen sich immer mehr Wassermoleküle zusammen.
5d) Bildung von Wassertropfen
Moleküle ziehen sich zusammen, wenn das eine mit seinem negativen Kraftbereich das positive Zentrum des anderen erreicht.
Das kann einmal passieren, wenn es negative Energie aufnimmt (z.B. langwellige Minos). Das tun die Nachbarn in der Atmosphäre aber auch. In diesem Fall kann es sogar zur Verdunstung führen.
Zum anderen können die Moleküle aufgrund ihrer hohen Bewegungsgeschwindigkeit (bis mehrfache Schallgeschwindigkeit) in der Luft beim zufälligen Zusammenstoss ihre negative Kraft am Molekülrand überwinden und zusammenbleiben.
Schliesslich haben diese Moleküle in einigen km Höhe nur noch einen kleinen negativen Rand. Sie sind schon ‚neutraler’.
Um so grösser ein Wassertropfen wächst, um so positiver wird er nach aussen und zieht um so mehr noch ‚Negative’ an.
5e) Fallender Luftdruck lässt Wasser regnen
Fällt der Luftdruck, so geben sie Minos ab (wird kälter) und die Moleküle reduzieren ihre bisherige gegenseitige negative Abstossung.
Sie binden sich zu immer grösseren Tropfen.
Gleichzeitig verlieren sie negative Energie an den Bindungsseiten.
Diese positiver werdenden Tropfen bräuchten immer mehr Umgebungsdruck um oben zu bleiben. Sie werden von der negativen Gravitation des Erdmantels zunehmend besser angezogen.
Schliesslich fallen sie als Regen in Richtung des negativen Erdmantels.
6) Sonstiges zum Wasser
zu Wasser zum Inhaltsverzeichnis . . zurück zum Anfang
6a) Eis positiv
Tiefgefrorenes Eis ist noch positiver.
Es ist 'grobkörniger' und rutscht und haftet weniger.
Die Erde hat ein Magnetfeld mit den Eismassen an Nord- und Südpol als Magnetpole.
6b) Minusüberdruck oberhalb 0 K
Die Sonne strahlt laufend Wärme- Minos zur Erde, von denen viele über den gesamten Tag wieder nach aussen wegdriften.
Durch diese Minoszufuhr entsteht ein Überdruck an Minos, der auch die Lufttemperatur liefert.
Ohne Überdruck durch Gravitation und Sonneneinstrahlung hätten die Atome 0 K.
Die Wärmeschalen haben dann keine überschüssigen Minos mehr, die durch Überschuss oder andere Kräfte mehr oder weniger lang am Atomrand blieben.
6c) Kalte / warme Autobatterie
Eine eiskalte Auto-Batterie arbeitet nicht.
Sowohl auf der Plus, als auch auf der Minusseite fehlt Temperatur (Minos) im selben Ausmass.
Die Elektro-Minos fliessen nicht, obwohl fast genauso viele drinnen sind.
Die Atome haben in überlappenden Schalen zuwenig negative Energie. Sie können nicht leiten und lassen keine Minos weg.
6d) Wasser und Wärmeminos in Autobatterie
Im Inneren ist die Autobatterie flüssig (destilliertes Wasser).
Damit hat diese Flüssigkeit einen Überschuss an Minos, welche ihre Moleküle beweglich auf Distanz hält.
Kühlt man die Batterie ab, so verlieren ihre Moleküle in allen überlappenden (leitfähigen) Schalen Minos.
Um so weiter innen die Schalen am Atomrand sind, um so kurzwelliger sind sie, das heisst, um so weniger Spannung haben sie.
Bei unter 1,5 Volt gehen die Schalen mit den Minos des leitfähigen elektrischen Stroms nahtlos in die der Wärme über.
Die Wärmeminos befinden sich vor allem zwischen den Elektroschalen und den viel weiter innen befindlichen Lichtschalen.
6e) Wärmeverlust induziert mehr Kraft auf die Elektroschalen
Beim Wärmeverlust verliert Wasser auch einen Teil an Elektrominos. Bei Wärmeaufnahme nimmt es auch Elektros mit auf.
Verlieren die Atome Wärmeminos, so wirkt mehr positive Kraft auf die Elektroschalen (12 V).
Das Atom zieht die nicht abgegebenen Elektros nun etwas stärker an.
Sie können sich nicht mehr so bewegen und fliessen nicht weiter.
Die Autobatterie arbeitet bis zur erneuten Wärmezufuhr entsprechend weniger.
6f) Supraleiter
Wärme hält die Elektroschalen auf grösserer Distanz zum Atom.
Nimmt man die kurzwellige Wärme weg (je nach Element bzw. Verbindung bis 0 K), so kann das Atom viel mächtigere Elektroschalen halten.
Die Atome sind nun supraleitend.
Das kommt aber sehr mit auf das Material an. Bei Cu und vielen anderen funktioniert es. Bei Wasser kann bei Wärmeabgabe auch das Gegenteil eintreten.
6g) Durchbrennen der Leitung
Jede Stromschale transportiert auch kurzwelligere Wärmeminos mit.
Um so kurzwelliger, um so weiter innen fliessen sie und um so besser müssen sie von einer Schale zur Schale des Nachbaratoms eine Kurve bzw. ein engeres Eck überwinden.
Wird die Stromgeschwindigkeit bzw. die Dichte zu hoch, so packen immer mehr Kurzweller diese Kurven nicht.
Sie springen in Schalen weiter innen und erhöhen so den Abstand zwischen den Atomen bis die Leitung durchbrennt.
Schliesslich geht die Supraleitfähigkeit wieder verloren.
Führt man Supraleitern Wärme zu, so fällt die Mächtigkeit ihrer Elektroschalen.
Gleichzeitig drückt es die Elektroschalen etwas nach aussen.
6h) Minustemperatur bei Fe und Wasser
Fasst man mit der blanken Hand gefrorenes Eisen an, so bleibt die Hand daran kleben.
Fe wirkt gefroren noch positiver, wogegen die Hand am Rand aufgrund ihrer Wärme sehr negativ ist.
Wasser gefriert, wenn es genug Minos am Rande abgibt. Es wird positiver.
Im Winter bringt die Sonne weniger Kurzweller durch die Atmosphäre. Die Moleküle geben sie schnell genug wieder ab und schmelzen nicht.
6i) Ultradünne Wasserschichten an der Grenzfläche zu Eis
Ultradünne Wasserschichten zeigen an der Grenzfläche zu Eis unerwartete Eigenschaften, die von großer Bedeutung für Natur und Technik sind.
Jeder weiß es: Eis
schmilzt bei null Grad Celsius. Auf diese Weise wurde sogar der Nullpunkt der
Celsius-Skala festgelegt. Nun aber haben Wissenschaftler vom
Max-Planck-Institut für Metallforschung in Stuttgart überraschend beobachtet,
dass Eis an der Grenzfläche zu einem Mineral wie Siliziumdioxid schon bei minus
17 Grad Celsius zu schmelzen beginnt, also weit unterhalb des Gefrierpunktes.
Bei der genauen Analyse der nur wenige Nanometer dünnen Schicht aus Wasser
stellten die Forscher fest, dass dieses Wasser mit einer Dichte von etwa 1.2
Gramm pro Kubikzentimeter 20 Prozent kompakter ist als normales Wasser. Die
erstmalige Entdeckung hochdichten Wassers gelang mit Hilfe hochbrillanter
Röntgenstrahlung, doch was genau zu seiner Entstehung führt, ist noch unbekannt
(Physical Review Letters, 2004, in Druck). Da die Erdkruste hauptsächlich aus
Siliziumdioxid besteht, könnte diese Entdeckung wichtig sein für das
Verständnis von Gletscherbewegungen oder die Stabilität von Permafrostböden, aber
auch für andere Phänomene, wie die Vereisung von Flugzeugtragflächen oder die
Bewegung von Fahrzeugen auf gefrorener Fahrbahn.
zu Wasser zum Inhaltsverzeichnis . . zurück zum Anfang